 Durante un año calendario completo (de enero a diciembre del 2010), Yu Chen et al estudiaron 811 niños menores de 5 años de edad, con diarrea aguda, atendidos en forma ambulatoria en siete hospitales del sureste de China. Tomaron algunos datos clínicos y examinaron muestras fecales de estos niños para identificar la presencia de cualquiera de los siguientes cinco virus enteropatógenos: rotavirus (A, B y C), norovirus (genogrupos I y II), sapovirus, adenovirus y astrovirus (ref). Rotavirus A se buscó por enzimoinmunoensayo (ELISA) y los otros virus (incluyendo rotavirus B y C) por multiplex Reverse Transcription-PCR (RT-PCR). Los genotipos G y P de rotavirus A se caracterizaron mediante RT-PCR. Continue reading “(13-70) Aquí o en la China, norovirus y rotavirus son la causa más frecuente de gastroenteritis en niños”
Durante un año calendario completo (de enero a diciembre del 2010), Yu Chen et al estudiaron 811 niños menores de 5 años de edad, con diarrea aguda, atendidos en forma ambulatoria en siete hospitales del sureste de China. Tomaron algunos datos clínicos y examinaron muestras fecales de estos niños para identificar la presencia de cualquiera de los siguientes cinco virus enteropatógenos: rotavirus (A, B y C), norovirus (genogrupos I y II), sapovirus, adenovirus y astrovirus (ref). Rotavirus A se buscó por enzimoinmunoensayo (ELISA) y los otros virus (incluyendo rotavirus B y C) por multiplex Reverse Transcription-PCR (RT-PCR). Los genotipos G y P de rotavirus A se caracterizaron mediante RT-PCR. Continue reading “(13-70) Aquí o en la China, norovirus y rotavirus son la causa más frecuente de gastroenteritis en niños”
(12-65) Alto nivel de contaminación con Campylobacter en plantas de procesamiento de pollos y mercados tradicionales
 Campylobacter es la causa más frecuente de diarrea causada por bacterias en el Perú (ref), lo que se atribuyó inicialmente a la costumbre de muchas familias de convivir en su vivienda con pollos no encorralados (ref). Más recientemente, utilizando técnicas de identificación molecular de cepas, un estudio en las Pampas de San Juan, Lima, mostró que sólo 35%-39% de las cepas de Campylobacter aisladas en niños o adultos con diarrea eran molecularmente idénticas a las aisladas en los pollos vivos no encorralados de sus respectivas viviendas (ref), lo cual subraya la posibilidad de que gran parte de las infecciones con esta bacteria se obtenga realmente de pollos que se adquieren para consumo en los mercados. Continue reading “(12-65) Alto nivel de contaminación con Campylobacter en plantas de procesamiento de pollos y mercados tradicionales”
Campylobacter es la causa más frecuente de diarrea causada por bacterias en el Perú (ref), lo que se atribuyó inicialmente a la costumbre de muchas familias de convivir en su vivienda con pollos no encorralados (ref). Más recientemente, utilizando técnicas de identificación molecular de cepas, un estudio en las Pampas de San Juan, Lima, mostró que sólo 35%-39% de las cepas de Campylobacter aisladas en niños o adultos con diarrea eran molecularmente idénticas a las aisladas en los pollos vivos no encorralados de sus respectivas viviendas (ref), lo cual subraya la posibilidad de que gran parte de las infecciones con esta bacteria se obtenga realmente de pollos que se adquieren para consumo en los mercados. Continue reading “(12-65) Alto nivel de contaminación con Campylobacter en plantas de procesamiento de pollos y mercados tradicionales”
(12-64) La infección por virus influenza puede presentarse con diarrea…sin síntomas respiratorios
 La infección por virus influenza, un patógeno primariamente respiratorio, con cierta frecuencia se presenta además con síntomas gastrointestinales, particularmente diarrea (ref). Por otro lado, se ha mostrado que el virus influenza se excreta en las heces de personas con influenza (ref) (ref) (ref). Además, se ha probado que el virus influenza se puede replicar eficientemente en células epiteliales de intestino humano (ref). Significa todo esto que debemos considerar al virus influenza como un patógeno intestinal más, al lado de rotavirus, norovirus, astrovirus o adenovirus, enteropatógenos virales cuyo rol como causantes de diarrea está bien establecido? Continue reading “(12-64) La infección por virus influenza puede presentarse con diarrea…sin síntomas respiratorios”
La infección por virus influenza, un patógeno primariamente respiratorio, con cierta frecuencia se presenta además con síntomas gastrointestinales, particularmente diarrea (ref). Por otro lado, se ha mostrado que el virus influenza se excreta en las heces de personas con influenza (ref) (ref) (ref). Además, se ha probado que el virus influenza se puede replicar eficientemente en células epiteliales de intestino humano (ref). Significa todo esto que debemos considerar al virus influenza como un patógeno intestinal más, al lado de rotavirus, norovirus, astrovirus o adenovirus, enteropatógenos virales cuyo rol como causantes de diarrea está bien establecido? Continue reading “(12-64) La infección por virus influenza puede presentarse con diarrea…sin síntomas respiratorios”
(12-62) El cólera sigue su expansión en el Caribe: ahora está en Cuba

La Séptima Pandemia de Cólera empezó en 1961 en Indonesia y de allí se extendió progresivamente al resto del Continente Asiático, Africa, parte de Europa y finalmente, 30 años después, llegó a las Américas en 1991. Su puerta de entrada fue Perú, causando una epidemia de gigantescas proporciones. Desde Perú, la bacteria del cólera se propagó a todos los países del Continente (con excepción de Uruguay) y, notablemente, no afectó ninguna de las islas del Caribe. La epidemia en las Américas se fue extinguiendo progresivamente y no se describieron más casos de cólera después del 2002. Su paso por nuestro Continente ha servido para mejorar el abastecimiento y la calidad del agua tanto en áreas urbanas como rurales e incrementar la infraestructura de saneamiento de aguas residuales en las grandes ciudades También, la población aprendió la importancia de la higiene personal y la higiene de los alimentos en la prevención de esta terrible enfermedad. Continue reading “(12-62) El cólera sigue su expansión en el Caribe: ahora está en Cuba”
(12-59) C. difficile se adquiere en la comunidad (no solamente en el hospital)
Una maravilla. El Condado de Olmsted, en el estado de Minnesota, es el territorio donde está la ciudad de Rochester, sede de la famosa Clínica Mayo. El área total del condado es 1,695.1 km2 y tiene, según el censo del 2010, 144,248 habitantes. En términos comparativos, es casi del mismo tamaño que la provincia de Trujillo, Perú (1,768.6 km2) aunque Trujillo tiene 811,979 habitantes, según el censo del 2007. Lo interesante del Condado de Olmsted es que es uno de los pocos lugares de los Estados Unidos y quizás del mundo que desde hace casi 50 años tiene un sistema que almacena en una base de datos única la información de la historia clínica (diagnósticos, admisiones al hospital, procedimientos quirúrgicos, resultados de exámenes de laboratorio, imágenes, vacunas recibidas y medicamentos prescritos) de virtualmente todos los habitantes del condado. Continue reading “(12-59) C. difficile se adquiere en la comunidad (no solamente en el hospital)”
(12-58) Anisakidosis – una enfermedad emergente en el Perú?
Citando una publicación reciente de peru.com, que da cuenta de la muerte de cientos de pelícanos en el litoral norte del Perú y los hallazgos del Dr. Carlos Bocanegra de la Universidad Nacional de Trujillo quien sostiene que estas muertes se deberían a inanición de las aves por ausencia de anchoveta y cierta parasitosis, un experto de Pro-MED (Program for Monitoring Emerging Diseases), un sitio web patrocinado por la International Society for Infectious Diseases, especula que el parásito al que hace referencia el Dr. Bocanegra podría ser Contracaecum spp, un nemátode del orden Ascaridida, familia Anisakidae (ProMED 06 May 2012 Pelican die-off – Peru: parasites and malnutrition). Continue reading “(12-58) Anisakidosis – una enfermedad emergente en el Perú?”
(12-56) Gatifloxacina versus ciprofloxacina para shigelosis
El estudio. En un ensayo clínico de etiqueta abierta cuyo propósito fue evaluar la eficacia clínica y bacteriológica de gatifloxacina (una fluorquinolona de cuarta generación) en comparación con ciprofloxacina para tratar shigelosis en niños , Vinh H et al (ref) asignaron aleatoriamente 500 niños con disentería de dos hospitales del sur de Vietnam, una región con alta prevalencia de resistencia de Shigella a ácido nalidíxico, para recibir por vía oral gatifloxacina (10 mg/kg/día, una vez al día por 3 días, grupo GATI) o ciprofloxacina (30 mg/kg/día, dividido en 2 dosis por día por 3 días, grupo CIPRO). Para comparar los tratamientos, los investigadores eligieron como indicador principal de resultado la proporción de fracaso terapéutico en cada grupo; el indicador secundario elegido fue el tiempo hasta el cese de síntomas individuales.
Los métodos. Los participantes fueron niños de hasta 15 años de edad con historia de diarrea con moco o sangre de no más de 72 horas de duración; fueron excluidos aquellos con algún signo de infección severa (shock, ictericia, sangrado gastrointestinal), historia de haber recibido algún antimicrobiano por este episodio de diarrea, historia de hipersensibilidad a alguna de las drogas de estudio o presencia de trofozoitos de Entamoeba histolytica en las heces. Se hizo cultivo de heces al momento del enrolamiento en el estudio, los niños fueron tratados con el medicamento respectivo antes de conocerse el resultado del cultivo y continuaron en el ensayo aún si este cultivo fue negativo para Shigella o positivo para alguna otra bacteria enteropatógena. Todos los niños fueron tratados intrahospitalariamente y salieron de alta sólo cuando desaparecieron todos los síntomas. Se anotó diariamente las características de cada deposición así como la temperatura corporal y otros signos clínicos de cada niño hasta el alta. Después del alta los pacientes fueron invitados a regresar para una nueva evaluación a los 7 días. Se definió como fracaso terapéutico la persistencia de fiebre o cualquier otro signo de la enfermedad después de 120 horas desde iniciado el tratamiento. Para evaluar la eficacia microbiológica, se tomó un nuevo cultivo de heces a los 7 días después del alta y se definió como fracaso microbiológico la persistencia de cultivo positivo al enteropatógeno originalmente hallado.
La muestra. De 500 pacientes enrolados originalmente, 494 recibieron al menos una dosis del medicamento en estudio (249 gatifloxacina y 245 ciprofloxacina) y sus datos fueron usados en el análisis de intención-de-tratamiento (ITT). El cultivo de heces inicial dio positivo a Shigella en 61 (24.5%) pacientes del grupo GATI y 46 (18.8%) del grupo CIPRO. Veinticinco pacientes (10.0%) en el grupo GATI y 15 (6.1%) en el grupo CIPRO tuvieron cultivo positivo a Salmonella. Los demás pacientes (163 [65.5%] en el grupo GATI y 182 [74.3%] en el grupo CIPRO) tuvieron cultivo negativo. De los aislamientos de Shigella, 72 (67.3%) fueron S. sonnei, 33 (30.8%) S. flexneri y 2 (1.9%) S. boydii. Setenta y dos (67.3%) de todos los aislamientos de Shigella fueron resistentes a ácido nalidíxico (MIC ≥ 16 µg/ml). La edad promedio de los pacientes participantes fue de 19 meses, 58.9% fueron de sexo masculino, el tiempo promedio de enfermedad antes de entrar al estudio fue de 24 horas, 87.4% tenían fiebre (> 37.8°C) al momento del ingreso, 42.5% tenían historia de diarrea con sangre y los demás, historia de diarrea con moco sin sangre. No hubo diferencias entre los grupos en cuanto a las características clínicas iniciales. De los pacientes positivos a Shigella, sólo 46 en el grupo GATI y 35 en el grupo CIPRO retornaron a su cita de seguimiento, 7 días después del alta del hospital.
Los resultados. De todos los pacientes ITT, 57 (11.5%) hicieron fracaso terapéutico (30 en el grupo GATI y 27 en el grupo CIPRO, p = 0.72). El patrón clínico de fracaso en la mayoría fue persistencia de la diarrea. Hubo 9 pacientes con fracaso bacteriológico en el grupo CIPRO y 6 en el grupo GATI. No hubo diferencias entre los grupos en el tiempo hasta la resolución de los síntomas individuales. En el análisis por-protocolo (pacientes con cultivo positivo a Shigella), el riesgo de fracaso terapéutico fue similar en ambos grupos (6.6% en el grupo GATI y 10.9% en el grupo CIPRO, p = 0.49), independientemente de si la cepa fue o no resistente a ácido nalidíxico; tampoco hubo diferencia en el tiempo hasta la resolución de los síntomas individuales. En los pacientes con cultivo positivo a Salmonella el fracaso terapéutico fue más alto que en los pacientes con Shigella pero sin diferencia entre los grupos (52.0% en el grupo GATI y 60.0% en el grupo CIPRO, p = 0.62). En los pacientes con cultivo negativo el fracaso terapéutico fue de 8.0% en el grupo GATI y 6.0% en el grupo CIPRO (p = 0.48).
En conclusión. Los datos de este estudio demuestran que a pesar de un alto porcentaje de resistencia a ácido nalidíxico, ciprofloxacina sigue siendo una terapia efectiva para la disentería causada por Shigella. Este estudio demuestra también que gatifloxacina es tan efectiva como ciprofloxacina para el tratamiento de esta enfermedad, incluyendo la disentería con cultivo negativo. En este estudio se muestra que ambos productos actúan pobremente cuando la disentería es causada por Salmonella. Una nota de cautela debe tomarse en cuenta en la generalización de los hallazgos de este estudio con relación a shigelosis ya que el serogrupo predominante en este estudio fue S. sonnei, que se sabe es menos virulento que S. flexneri (ref).
- Se ha documentado recientemente que está ocurriendo, al menos en Asia, un dramático giro en la epidemiología de la shigelosis, en dos aspectos: 1) ha desaparecido S. dysenteriae (el serogrupo más virulento) y S. sonnei, que antes se encontraba casi exclusivamente en los países industrializados, está sustituyendo a S. flexneri, hasta hace poco el serogrupo más común en los países en desarrollo (ref) y 2) está cambiando el patrón de susceptibilidad de Shigella a los antibióticos con un elevado porcentaje de resistencia a ácido nalidíxico (ref) y una rápida emergencia de cepas resistentes a cefalosporinas de tercera generación (ref). Interesantemente, la resistencia a ácido nalidíxico generalmente correlaciona con disminución de la susceptibilidad in vitro a ciprofloxacina y otras fluoroquinolonas de primera generación (ref), que estaría mediado por mutaciones de resistencia comunes a varios antimicrobianos (ref). Los resultados del estudio que comentamos indica que tal correlación no pareciera ocurrir in vivo.
- Gatifloxacina es una fluoroquinolona de cuarta generación con actividad contra Gram positivos y Gram negativos con un espectro de acción más amplio que las fluoroquinolonas anteriores (ref). Como otras quinolonas, gatifloxacina penetra activamente en el citoplasma de las células fagocíticas y tiene por tanto actividad bactericida contra bacterias intracelulares como Shigella (ref). Gatifloxacina se absorbe bien en el tracto gastrointestinal con una biodisponibilidad de 100% por lo que se puede pasar a un paciente de terapia intravenosa a oral sin necesidad de ajustar la dosis; tiene un tiempo de vida media en plasma prolongado por lo que se puede administrar en una dosis al día (ref). Gatifloxacina está aprobado en los Estados Unidos para el tratamiento de neumonía adquirida en la comunidad, exacerbaciones agudas de bronquitis crónica, sinusitis aguda, infección urinaria complicada o no complicada, pielonefritis, gonorrea e infecciones no complicadas de la piel y faneras (ref). Varios ensayos clínicos han mostrado que gatifloxacina es muy efectiva en el tratamiento de fiebre tifoidea comparado con cefixima (ref), azitromicina (ref) o cloranfenicol (ref).
- Gatifloxacina es un medicamento con buen perfil de seguridad y tolerancia; los eventos adversos más frecuentemente reportados en adultos son náusea (8%), diarrea (4%), cefalea (4%) y mareos (3%) (ref). Se ha reportado un estado de disglicemia (híper o hipoglicemia) asociado al uso de gatifloxacina; aunque el riesgo de disglicemia parece bajo, algunos recomiendan monitorear la glucosa sanguínea durante el tratamiento (ref). Gatifloxacina parece un medicamento seguro para niños; en un estudio de 867 niños con otitis media recurrente u otitis media aguda que no responde a medicación de primera línea y que fueron subsecuentemente tratados con gatifloxacina, ninguno desarrolló artropatía (ref).
(12-55) Es Candida albicans un patógeno intestinal?
Este artículo está dedicado con gratitud y aprecio al Dr. Raúl León Barúa, maestro de numerosas generaciones de médicos en el Perú que se han nutrido de sus enseñanzas y pensamiento visionario. Hace poco más de 30 años el Dr. León Barúa insistía que Candida albicans era patógena sólo cuando estaba en su forma filamentosa (hifas) y no en la de levadura, como tan elegantemente lo muestran ahora los investigadores cuyo artículo resumimos y comentamos a continuación – ESL
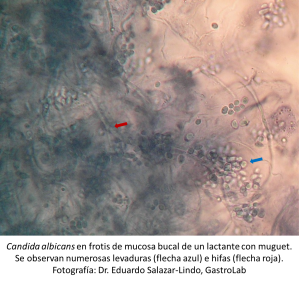 En el numero de febrero 2012 de la revista Nature Reviews Microbiology (ref), NA Gow et al de la Aberdeen Fungal Group, School of Medical Sciences, Institute of Medical Sciences, University of Aberdeen, Aberdeen, UK hacen una revisión del proceso de morfogénesis por el que Candida albicans se transforma de la forma comensal (levadura) a la forma invasiva, filamentosa (hifas) y de cómo el huésped tolera la cándida cuando está en levadura y la rechaza cuando está en su forma filamentosa. Esta propiedad de polimorfismo en el ciclo de vida de C. albicans la presentan también varios otros hongos patógenos como Histoplasma capsulatum, Paracoccidioides brasiliensis, Penicillium marneffei y Blastomycoides dermatitidis. Una diferencia notable, sin embargo, es que C. albicans crece en las dos formas en el intestino humano (ref), mientras los otros hongos hacen la fase filamentosa obligatoriamente en el medio ambiente y se convierten a la forma de levadura sólo cuando entran en contacto con tejido humano (ref).
En el numero de febrero 2012 de la revista Nature Reviews Microbiology (ref), NA Gow et al de la Aberdeen Fungal Group, School of Medical Sciences, Institute of Medical Sciences, University of Aberdeen, Aberdeen, UK hacen una revisión del proceso de morfogénesis por el que Candida albicans se transforma de la forma comensal (levadura) a la forma invasiva, filamentosa (hifas) y de cómo el huésped tolera la cándida cuando está en levadura y la rechaza cuando está en su forma filamentosa. Esta propiedad de polimorfismo en el ciclo de vida de C. albicans la presentan también varios otros hongos patógenos como Histoplasma capsulatum, Paracoccidioides brasiliensis, Penicillium marneffei y Blastomycoides dermatitidis. Una diferencia notable, sin embargo, es que C. albicans crece en las dos formas en el intestino humano (ref), mientras los otros hongos hacen la fase filamentosa obligatoriamente en el medio ambiente y se convierten a la forma de levadura sólo cuando entran en contacto con tejido humano (ref).
La piel, la mucosa genital y la mucosa bucal e intestinal están colonizadas por C. albicans en 30-70% de individuos sanos (ref). Normalmente es una cantidad relativamente pequeña de levaduras que está sólo en la superficie, no daña la célula epitelial y por tanto no estimula las células dendríticas del epitelio ni despierta una respuesta de rechazo de los macrófagos de la mucosa subyacente. El huésped debe disponer de mecanismos para mantener la cantidad de C. albicans debajo de un umbral de tolerancia así como distinguir la forma no-patógena (levadura) de la forma invasiva filamentosa para mantener la homeostasis (ref). Cuando se altera la composición de la flora bacteriana comensal de las superficies mucosas o si falla el sistema inmune de reconocimiento, como ocurre en las enfermedades por inmunodeficiencia, las levaduras de C. albicans se multiplican, se transforman en su forma filamentosa, invaden el epitelio hasta la mucosa y eventualmente los vasos sanguíneos (ref) (ref). El espectro de la enfermedad invasiva puede ir desde una infección circunscrita a la mucosa (p.ej., muguet oral o candidiasis vulvovaginal) hasta enfermedades severas como infección sistémica (candidemia) o candidiasis mucocutánea crónica. Se ha propuesto también que una respuesta inmunológica distorsionada a C. albicans podría ser la base fisiopatológica de la auto-inflamación que ocurre en la enfermedad de Crohn (ref).
C. albicans invade el epitelio sea por endocitosis o directamente. Las hifas son más eficientes que las levaduras para inducir endocitosis lo que hace suponer que la conversión de levadura a hifa implica una modificación en la composición proteica de su pared celular que facilita la fijación a receptores de la célula epitelial que inician la endocitosis (ref). La invasión por penetración directa es casi completamente una función de las hifas y no de la levadura y conlleva un daño de la célula epitelial (ref). Por otro lado, el sistema inmune del huésped deja de reconocer como no-patógeno a C. albicans cuando se transforma en hifas y algunos experimentos demuestran que este cambio de reconocimiento tiene que ver con el contenido de quitina que es 3-5 veces mayor en la pared celular de las hifas que en las levaduras (ref) y que la quitina en las levaduras no está expuesta como proteína de superficie porque reside principalmente en la cicatriz de gemación, estructura que las hifas no tienen (ref). Esta diferencia es importante porque la quitina bloquea el reconocimiento de C. albicans por el sistema inmune (ref), un paso esencial para iniciar los mecanismos de defensa del huésped.
Aunque se ha avanzado bastante en la dilucidación de los mecanismos por los cuales el sistema inmune del huésped discrimina entre invasión y colonización de la mucosa por C. albicans, el modelo completo de está interacción está sólo parcialmente descubierto. Los autores especulan que estos hallazgos pudieran ser relevantes también para entender los mecanismos de tolerancia y rechazo del huésped hacia otros hongos y bacterias (ref).
(12-51) Helicobacter pylori protege contra Shigella y otras infecciones intestinales
Cohen D et al del Department of Epidemiology and Preventive Medicine, School of Public Health, Sackler Faculty of Medicine, Tel Aviv University, Israel, diseñaron un estudio caso-control con el propósito de averiguar si la infección por Helicobacter pylori confería algún tipo de protección contra infecciones intestinales (ref). El estudio se hizo con soldados israelíes conscriptos, varones, de 18 a 21 años de edad, seleccionando como casos (n = 177) a aquellos que consultaron por diarrea en los servicios médicos de su unidad y que proporcionaron una muestra de heces para cultivo. Los casos fueron positivos para Shigella sonnei (n = 66), Escherichia coli enterotoxigénica (ETEC) (n = 31) o negativos para patógenos bacterianos (n = 80, diarrea de etiología desconocida). Los controles (n = 418) fueron seleccionados entre soldados de la misma unidad sin enfermedad diarreica en el mismo periodo. Se analizó la presencia de anticuerpos tipo IgG contra H. pylori y anticuerpos tipo IgG e IgA contra el lipopolisacárido de S. sonnei en una muestra de suero pre-existente que había sido obtenida al comenzar su servicio militar en todos los soldados participantes. La proporción de sujetos con evidencia serológica de infección por H. pylori fue significativamente más alta en los controles (56.0%) que en los que tenían infección intestinal de etiología desconocida (36.3%) (OR ajustado, 0.43; 95% CI: 0.24-0.77; P = 0.005) y en los que tenían infección por S. sonnei (36.3%), aún ajustando a variables socio-demográficas y pre-existencia de anticuerpos tipo IgA (OR ajustado, 0.37; 95% CI: 0.14-0.95; P = 0.03) o IgG (OR ajustado, 0.38; 95% CI: 0.14-0.99; P = 0.04) contra S. sonnei. La asociación entre infección por H. pylori y diarrea por ETEC fue similar y en la misma dirección aunque no estadísticamente significativa. Los autores concluyen que estos hallazgos sugieren que el H. pylori tiene un rol activo de protección contra shigellosis y quizás también contra otras enfermedades diarreicas, mas allá de la protección adquirida en forma natural de infecciones previas con patógenos entéricos.
- Observaciones clínicas (ref) y estudios experimentales en humanos (ref) y animales de laboratorio (ref) indican que los enteropatógenos no sobreviven en un medio acido y por tanto el ácido gástrico puede ser una barrera de protección contra las infecciones intestinales. Un extenso meta-análisis publicado muy recientemente demuestra que la hipoclorhidria generada por el uso de inhibidores de bomba de protones favorece la colonización bacteriana e incrementa la susceptibilidad a infecciones intestinales (ref).
- Se ha señalado que la infección aguda por H. pylori causa hipoclorhidria que empieza dos semanas después de la infección y que puede durar hasta cuatro meses (ref). En teoría, los pacientes infectados con H. pylori pueden entonces ser más susceptibles a adquirir infecciones intestinales al menos durante este periodo de hipoclorhidria. Estudios epidemiológicos muestran aparentemente esta posible asociación (ref) (ref) (ref).
- El estudio de Cohen D et al (ref), que comentamos aquí, y algunos otros más publicados previamente (ref) (ref), muestran al contrario que la infección por H. pylori confiere una protección contra las infecciones intestinales. Estos hallazgos contradictorios se podrían explicar de la siguiente manera: 1) Durante el curso de una infección crónica por H. pylori se induce una respuesta inflamatoria local y sistémica persistente que mantienen en actividad la respuesta inmune (ref), lo que podría conferir una protección inespecífica contra los enteropatógenos; 2) En la infección crónica con H. pylori y gastritis predominantemente antral hay mas bien un estado de hiperclorhidria que potencia la barrera acida gástrica contra los enteropatógenos (ref); 3) H. pylori induce el incremento de secreción de anticuerpos IgA que tienen un rol fundamental en impedir la colonización de la mucosa intestinal por patógenos intestinales (ref); 4) Las cepas CagA de H. pylori inducen la síntesis de péptidos específicos que incrementan la resistencia contra patógenos entéricos (ref). Las evidencias parecen más fuertes para apoyar la hipótesis del rol protector que tendría H. pylori para prevenir las infecciones intestinales.
- En la última década se está describiendo una tendencia a la disminución de la incidencia de infección por H. pylori en los países en desarrollo (ref) (ref). Si esta tendencia es real, se puede predecir que paralelamente podrían aumentar las infecciones intestinales.
(11-48) También en Venezuela, otros virus intestinales, además de rotavirus, contribuyen sustancialmente a la gastroenteritis en niños
En un estudio clínico epidemiológico con aplicación de técnicas inmunológicas y moleculares, González GG et al del Instituto Venezolano de Investigaciones Científicas (IVIC), Caracas, Venezuela y el Departamento de Microbiología, Escuela de Ciencias Biomédicas y Tecnológicas, Universidad de Carabobo, Valencia, Venezuela, evaluaron muestras fecales y revisaron los datos clínicos de 480 niños menores de 5 años de edad que fueron admitidos con gastroenteritis al Hospital de Niños Dr. Jorge Lizárraga de la ciudad de Valencia, Venezuela entre enero y diciembre del 2003. Las muestras se analizaron para determinar la presencia de rotavirus, adenovirus, norovirus, sapovirus y astrovirus, mediante ELISA y RT-PCR (PCR de trascripción reversa). Se hizo la caracterización filogenética de los virus identificados. La carga viral de norovirus se hizo mediante RT-PCR cuantitativo. Se identificó algún virus en 43% de las muestras examinadas, siendo rotavirus (21%) el más frecuente, seguido de norovirus (13%), adenovirus (5%), sapovirus (3%) y astrovirus (2%). La tasa de infección viral fue más alta (49%) en el grupo de niños de 6 a 11 meses de edad que en el grupo mayor de 2 años de edad (34%). Norovirus del grupo II (90%) fue más prevalente que del grupo I (10%). De las muestras positivas a adenovirus, 43% correspondían a los serotipos 40/41. La enfermedad clínica fue más severa con rotavirus, con más vómitos (84%), deshidratación (11%) y necesidad de hospitalización (20%) que con los demás virus. El patrón estacional fue diferente y opuesto entre rotavirus y norovirus (siendo rotavirus más frecuente en los meses más fríos y secos y norovirus en los meses lluviosos y más calientes). No se encontró correlación entre la carga viral de norovirus y la severidad de la enfermedad. (ref)
- Este estudio se hizo antes de la introducción de la vacuna contra rotavirus en Venezuela por lo que el espectro epidemiológico actual de la gastroenteritis viral en ese país podría haber cambiado, como se ha demostrado en los Estados Unidos 5 años después de la introducción de la vacuna pentavalente contra rotavirus (ref).
- Los resultados de este estudio concuerdan con varios otros en otras partes del mundo que indican que rotavirus no es el único virus responsable de la carga de enfermedad en la gastroenteritis viral endémica en niños (ref) (ref) (ref).
- En un estudio de nuestro laboratorio que se hizo entre junio 2006 a enero 2007 (también, antes de la introducción en el Perú de la vacuna contra rotavirus), se encontró norovirus (29.5%), rotavirus (22.6%), adenovirus (6.5%) y astrovirus (5.1%) en muestras fecales de 292 niños con gastroenteritis aguda y deshidratación de varios hospitales de Lima (ref).
- Sapovirus es uno de los cuatro géneros de la familia Calicivirus; al igual que norovirus, otro miembro de esta familia, sapovirus es agente causal de gastroenteritis en niños y adultos. Los otros dos calicivirus son lagovirus y vesivirus, que son patógenos sólo de animales como conejos y gatos (ref).
