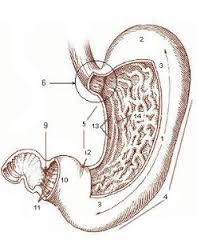
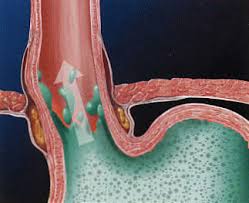
 Un cierto grado de reflujo es normal o fisiológico a cualquier edad, pero cuando la regurgitación se hace más frecuente y se asocian otros síntomas como ganancia de peso insatisfactoria, irritabilidad persistente, llanto inconsolable de dolor, dificultad para deglutir, inapetencia, rasgos de sangre en el vómito, episodios de apnea y cianosis (que no tiene otra explicación), tos y sibilancias, broncoaspiración o neumonía recurrente, tos crónica, estridor o ronquera, carraspeo, postura anormal del cuello y el tronco durante los episodios de reflujo (síndrome de Sandifer), el reflujo puede ser patológico y no meramente funcional. A esta condición se denomina Enfermedad por Reflujo Gastroesofágico (ERGE) en contraste con la denominación Reflujo Gastroesofágico (RGE) que se utiliza para referirse al reflujo fisiológico. La prevalencia de ERGE en la población pediátrica general es de 1 en 300. ERGE es más común en niños nacidos prematuramente, o con daño neurológico y retardo psico-motor, niños con hernia hiatal o después de cirugías de esófago para reparar atresia esofágica, también en niños con retardo del vaciamiento gástrico, alergia a proteína de leche de vaca o simplemente una incompetencia para mantener cerrado el esfínter esofágico inferior después de comer. Un reflujo fisiológico se puede convertir en patológico si el tratamiento posicional no es efectivo o la sobrealimentación mantiene una presión intragástrica constantemente elevada. Los síntomas de ERGE en niños más grandes reflejan principalmente la existencia de esofagitis de reflujo que se manifiesta con dolor en la parte baja del tórax, ardor epigástrico, vinagreras y deglución dolorosa o dificultosa; el niño mayor puede describir claramente estos síntomas además de la sensación de regurgitación y el llamado globus faríngeo. ERGE con esofagitis persistente refractaria a la medicación anti-ácida debe hacer considerar la posibilidad de esofagitis eosinofílica.
Un cierto grado de reflujo es normal o fisiológico a cualquier edad, pero cuando la regurgitación se hace más frecuente y se asocian otros síntomas como ganancia de peso insatisfactoria, irritabilidad persistente, llanto inconsolable de dolor, dificultad para deglutir, inapetencia, rasgos de sangre en el vómito, episodios de apnea y cianosis (que no tiene otra explicación), tos y sibilancias, broncoaspiración o neumonía recurrente, tos crónica, estridor o ronquera, carraspeo, postura anormal del cuello y el tronco durante los episodios de reflujo (síndrome de Sandifer), el reflujo puede ser patológico y no meramente funcional. A esta condición se denomina Enfermedad por Reflujo Gastroesofágico (ERGE) en contraste con la denominación Reflujo Gastroesofágico (RGE) que se utiliza para referirse al reflujo fisiológico. La prevalencia de ERGE en la población pediátrica general es de 1 en 300. ERGE es más común en niños nacidos prematuramente, o con daño neurológico y retardo psico-motor, niños con hernia hiatal o después de cirugías de esófago para reparar atresia esofágica, también en niños con retardo del vaciamiento gástrico, alergia a proteína de leche de vaca o simplemente una incompetencia para mantener cerrado el esfínter esofágico inferior después de comer. Un reflujo fisiológico se puede convertir en patológico si el tratamiento posicional no es efectivo o la sobrealimentación mantiene una presión intragástrica constantemente elevada. Los síntomas de ERGE en niños más grandes reflejan principalmente la existencia de esofagitis de reflujo que se manifiesta con dolor en la parte baja del tórax, ardor epigástrico, vinagreras y deglución dolorosa o dificultosa; el niño mayor puede describir claramente estos síntomas además de la sensación de regurgitación y el llamado globus faríngeo. ERGE con esofagitis persistente refractaria a la medicación anti-ácida debe hacer considerar la posibilidad de esofagitis eosinofílica.
Henry SM. Discerning differences: gastroesophageal reflux and gastroesophageal reflux disease in infants. Adv Neonatal Care 2004; 4:235-47 (PubMed 15368216).
Czinn SJ, et al. Gastroesophageal reflux disease in neonates and infants: when and how to treat. Paediatr Drugs 2013; 15:19-27 (PubMed 23322552).
Lightdale JR, et al. Gastroesophageal reflux: management guidance for the pediatrician. Pediatrics 2013; 131:e1684-95 (PubMed 23629618).