J van den Berg y MY Berger del Department of General Practice, Erasmus Medical Center, Erasmus University Rotterdam, the Netherlands, decidieron hacer una revisión de las guías de manejo de gastroenteritis aguda (AGE) en niños, con el fin de identificar las razones de la baja influencia de estas guías en la práctica real de los médicos de los países industrializados (ref). Su hipótesis fue que estas guías podrían adolecer de inconsistencia en las recomendaciones, recomendaciones sin suficientes evidencias o inaplicabilidad de las recomendaciones en términos prácticos.
Los autores ubicaron y revisaron las guías desarrolladas y publicadas por organizaciones médicas profesionales que estuvieran disponibles en algún sitio web; adicionalmente hicieron una búsqueda bibliográfica sistemática y obtuvieron y revisaron los artículos que contenían guías, consensos o protocolos de manejo. Consideraron válidos para este análisis las guías, consensos y protocolos que fueron elaborados expresamente para el manejo de la gastroenteritis en niños y producidos por una organización profesional que representa oficialmente a usuarios como pediatras, gastroenterólogos o médicos generales. Se excluyeron las que se basaron exclusivamente en opiniones o que fueron diseñados para países en desarrollo o para niños con con-morbilidades severas. Los autores seleccionaron y analizaron ocho guías que reunieron estos criterios (2 de USA: Cincinnati Children’s Hospital Medical Center y CDC; 2 de UK: ARM y NICE; 1 de Canadá: Canadian Pediatric Society; 1 de Holanda: NHG; 1 de Europa: ESPGHAN/ESPID; 1 mundial: WGO). Estas guías fueron publicadas entre el 2001 (ARM) y el 2009 (NICE).
La calidad de cada guía se evaluó con la herramienta AGREE (Appraisal of Guidelines for Research and Evaluation) (ref), que incluye 23 ítems agrupados en seis categorías (1/ alcance y finalidad, 2/ participación de las partes interesadas, 3/ rigurosidad del desarrollo, 4/ claridad y presentación, 5/ aplicabilidad y 6/ independencia editorial) y un ítem de evaluación global que juzga si la guía tiene o no méritos para recomendar su uso en la práctica clínica. Se definió como recomendación consistente si más del 50% de las guías revisadas daban la misma recomendación sobre un determinado tema. Las recomendaciones se consideraron aplicables o generalizables a la práctica clínica cotidiana si la evidencia que sustenta la recomendación fue obtenida de estudios con pacientes ambulatorios en centros de atención primaria o si participó al menos un médico general (general practitioner) en los casos en que la recomendación fue por consenso.
En la evaluación de calidad destacan las guías NICE y ESPGHAN/ESPID aunque en aplicabilidad, la guía NICE obtuvo un puntaje de 88.9% y la guía ESPGHAN/ESPID sólo 11.1%. Las guías con el más bajo puntaje en calidad fueron CDC, Canadian Pediatric Society y WGO.
El número de recomendaciones para diagnóstico y tratamiento es muy variable de guía a guía. La guía ESPGHAN/ESPID es la que hace más recomendaciones (n=74) pero sólo 47 (63.5%) son basadas en evidencias. La guía NICE hace 35 recomendaciones, de las cuales 21 (60%) son basadas en evidencias. La guía del CDC hace 35 recomendaciones pero sólo 40% son basadas en evidencias. La guía WGO no dice cuál fue la fuente de evidencia de sus recomendaciones.
En relación a los signos o síntomas para catalogar el grado de deshidratación la revisión encuentra que 1) el signo de pliegue es el único que aparece en todas las guías, 2) hay una enorme inconsistencia entre las guías sobre cuál signo indica qué grado de deshidratación y 3) ninguno de los signos ha sido estudiado en el contexto de atención primaria.
Todas las guías excepto una (Cincinnati Children’s Hospital Medical Center) recomiendan el uso de una solución de rehidratación oral (SRO) de baja osmolaridad para tratar o prevenir la deshidratación. Esta recomendación está basada en evidencias de muy buena calidad. Las recomendaciones sobre la cantidad de SRO a administrar, sin embargo, son inconsistentes. Todas las guías recomiendan que 1) la lactancia materna no deba interrumpirse durante la rehidratación y el resto del tratamiento, 2) que un alimento apropiado para la edad deba administrarse inmediatamente después de completar la rehidratación (4-6 horas) y 3) que es innecesario diluir la fórmula o utilizar una fórmula libre de lactosa.
Seis guías recomiendan 1) no usar bebidas con alto contenido de carbohidratos, 2) no usar antieméticos y 3) que los antidiarreicos no son de beneficio o no deben usarse. Las recomendaciones sobre el uso de probióticos son inconsistentes.
Cuatro guías recomiendan cuándo un paciente debe ser visto por un médico, según los siguientes factores de riesgo: corta edad, diarrea de gasto alto, deshidratación severa, vómito persistente, diarrea con sangre o asociada a fiebre alta, diarrea persistente o pre-existencia de alguna enfermedad de fondo relevante. Seis guías recomiendan solicitar un cultivo de heces cuando la diarrea es con sangre. Tres guías indican que los vómitos no son una contraindicación para la hidratación oral.
Los autores concluyen que el alto porcentaje que todavía subsiste de recomendaciones no basadas en evidencias y la inconsistencia de las guías entre sí son el factor principal de la poca adherencia a las recomendaciones en la práctica diaria. Para remediar esta situación sugieren que se hagan más estudios en al menos los siguientes temas: 1) determinar el valor de los signos clínicos de deshidratación para definir el grado de deshidratación de un niño que se atiende en un servicio de atención primaria; 2) establecer la cantidad optima de SRO que debe administrarse para cada grado de deshidratación; 3) determinar qué consideraciones llevan al médico a prescribir medicamentos a niños con gastroenteritis aguda y definir si estas consideraciones son o no validas. Finalmente, los autores también abogan por que se adopte un sistema uniforme de graduación, como el sistema GRADE (ref), para referirse a la robustez de una recomendación contenida en una guía.
- La rehidratación oral (TRO) es una terapéutica que se usa realmente muy poco (ref), pese a que su eficacia y aplicabilidad está basada en una montaña de evidencias. Este fiasco con la TRO es un buen ejemplo de cómo muchos médicos prefieren basar sus decisiones en su formación inicial o su experiencia con pacientes individuales que en las evidencias. El mero hecho de haber leído o estar familiarizado con recomendaciones formuladas por instituciones académicas a través de guías de manejo clínico, no garantiza que los médicos las apliquen en su práctica diaria. En un estudio en USA, tres cuartos de los médicos que fueron encuestados y que decían conocer de cerca las recomendaciones de la American Academy of Pediatrics acerca del uso de TRO, seguían usando exclusivamente rehidratación intravenosa en niños con deshidratación moderada (ref). En otro estudio, un número importante de médicos de emergencias pediátricas, a quienes se les mostró los datos que refutaban el argumento que TRO tomaba más tiempo del personal de salud y que dijeron entonces que usarían TRO para deshidratación leve o moderada, en realidad continuaron usando rehidratación intravenosa; esto fue especialmente más prevalente en médicos que se habían graduado en la escuela de medicina más tempranamente (ref). Es claro que hay otras barreras no explícitas que deben ser exploradas para incrementar la práctica de la medicina basada en evidencias.
- El camino para pasar de la medicina basada en la experiencia a la medicina basada en la evidencia es largo y difícil. La medicina basada en evidencias es “el proceso de convertir un problema clínico en preguntas y de allí, sistemáticamente, revisar, evaluar y utilizar los hallazgos de investigaciones clínicas contemporáneas como la base para tomar decisiones clínicas y proporcionar la atención más óptima posible al paciente.” (ref) Este proceso demanda del médico tiempo y capacitación para evaluar críticamente la extensa literatura médica y una actitud diferente para aplicar lo que otros aconsejan.
- El desarrollo y difusión de guías de manejo es un esfuerzo de una institución para entregarle al médico un conjunto de recomendaciones basada en evidencias que usualmente es elaborado por un equipo calificado de expertos en el tema. Los autores del artículo que comentamos aquí nos hacen ver que aún estas guías adolecen de precisión y consistencia cuando se usan herramientas como AGREE y GRADE para evaluar su contenido. Es notable que en una patología tan prevalente como la gastroenteritis aguda en niños sólo cuatro de las ocho guías actualmente disponibles pueden pasar aceptablemente un escrutinio riguroso de calidad y consistencia. La aplicabilidad seguirá siendo un problema porque tiene que ver con consideraciones más prosaicas como saber cuál es la verdadera motivación que puede llevar a un médico a mudarse de la medicina autoritaria a la medicina científica.
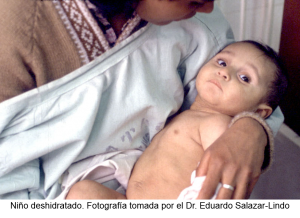 Qué es la deshidratación
Qué es la deshidratación