Este artículo está dedicado con gratitud y aprecio al Dr. Raúl León Barúa, maestro de numerosas generaciones de médicos en el Perú que se han nutrido de sus enseñanzas y pensamiento visionario. Hace poco más de 30 años el Dr. León Barúa insistía que Candida albicans era patógena sólo cuando estaba en su forma filamentosa (hifas) y no en la de levadura, como tan elegantemente lo muestran ahora los investigadores cuyo artículo resumimos y comentamos a continuación – ESL
 En el numero de febrero 2012 de la revista Nature Reviews Microbiology (ref), NA Gow et al de la Aberdeen Fungal Group, School of Medical Sciences, Institute of Medical Sciences, University of Aberdeen, Aberdeen, UK hacen una revisión del proceso de morfogénesis por el que Candida albicans se transforma de la forma comensal (levadura) a la forma invasiva, filamentosa (hifas) y de cómo el huésped tolera la cándida cuando está en levadura y la rechaza cuando está en su forma filamentosa. Esta propiedad de polimorfismo en el ciclo de vida de C. albicans la presentan también varios otros hongos patógenos como Histoplasma capsulatum, Paracoccidioides brasiliensis, Penicillium marneffei y Blastomycoides dermatitidis. Una diferencia notable, sin embargo, es que C. albicans crece en las dos formas en el intestino humano (ref), mientras los otros hongos hacen la fase filamentosa obligatoriamente en el medio ambiente y se convierten a la forma de levadura sólo cuando entran en contacto con tejido humano (ref).
En el numero de febrero 2012 de la revista Nature Reviews Microbiology (ref), NA Gow et al de la Aberdeen Fungal Group, School of Medical Sciences, Institute of Medical Sciences, University of Aberdeen, Aberdeen, UK hacen una revisión del proceso de morfogénesis por el que Candida albicans se transforma de la forma comensal (levadura) a la forma invasiva, filamentosa (hifas) y de cómo el huésped tolera la cándida cuando está en levadura y la rechaza cuando está en su forma filamentosa. Esta propiedad de polimorfismo en el ciclo de vida de C. albicans la presentan también varios otros hongos patógenos como Histoplasma capsulatum, Paracoccidioides brasiliensis, Penicillium marneffei y Blastomycoides dermatitidis. Una diferencia notable, sin embargo, es que C. albicans crece en las dos formas en el intestino humano (ref), mientras los otros hongos hacen la fase filamentosa obligatoriamente en el medio ambiente y se convierten a la forma de levadura sólo cuando entran en contacto con tejido humano (ref).
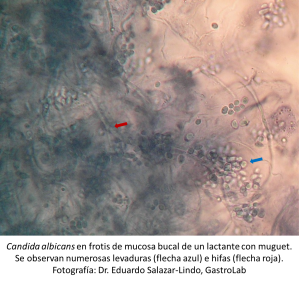
La piel, la mucosa genital y la mucosa bucal e intestinal están colonizadas por C. albicans en 30-70% de individuos sanos (ref). Normalmente es una cantidad relativamente pequeña de levaduras que está sólo en la superficie, no daña la célula epitelial y por tanto no estimula las células dendríticas del epitelio ni despierta una respuesta de rechazo de los macrófagos de la mucosa subyacente. El huésped debe disponer de mecanismos para mantener la cantidad de C. albicans debajo de un umbral de tolerancia así como distinguir la forma no-patógena (levadura) de la forma invasiva filamentosa para mantener la homeostasis (ref). Cuando se altera la composición de la flora bacteriana comensal de las superficies mucosas o si falla el sistema inmune de reconocimiento, como ocurre en las enfermedades por inmunodeficiencia, las levaduras de C. albicans se multiplican, se transforman en su forma filamentosa, invaden el epitelio hasta la mucosa y eventualmente los vasos sanguíneos (ref) (ref). El espectro de la enfermedad invasiva puede ir desde una infección circunscrita a la mucosa (p.ej., muguet oral o candidiasis vulvovaginal) hasta enfermedades severas como infección sistémica (candidemia) o candidiasis mucocutánea crónica. Se ha propuesto también que una respuesta inmunológica distorsionada a C. albicans podría ser la base fisiopatológica de la auto-inflamación que ocurre en la enfermedad de Crohn (ref).
C. albicans invade el epitelio sea por endocitosis o directamente. Las hifas son más eficientes que las levaduras para inducir endocitosis lo que hace suponer que la conversión de levadura a hifa implica una modificación en la composición proteica de su pared celular que facilita la fijación a receptores de la célula epitelial que inician la endocitosis (ref). La invasión por penetración directa es casi completamente una función de las hifas y no de la levadura y conlleva un daño de la célula epitelial (ref). Por otro lado, el sistema inmune del huésped deja de reconocer como no-patógeno a C. albicans cuando se transforma en hifas y algunos experimentos demuestran que este cambio de reconocimiento tiene que ver con el contenido de quitina que es 3-5 veces mayor en la pared celular de las hifas que en las levaduras (ref) y que la quitina en las levaduras no está expuesta como proteína de superficie porque reside principalmente en la cicatriz de gemación, estructura que las hifas no tienen (ref). Esta diferencia es importante porque la quitina bloquea el reconocimiento de C. albicans por el sistema inmune (ref), un paso esencial para iniciar los mecanismos de defensa del huésped.
Aunque se ha avanzado bastante en la dilucidación de los mecanismos por los cuales el sistema inmune del huésped discrimina entre invasión y colonización de la mucosa por C. albicans, el modelo completo de está interacción está sólo parcialmente descubierto. Los autores especulan que estos hallazgos pudieran ser relevantes también para entender los mecanismos de tolerancia y rechazo del huésped hacia otros hongos y bacterias (ref).
