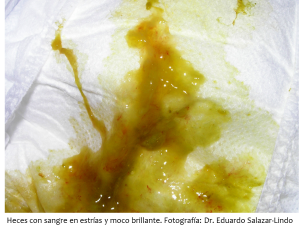
 La situación más o menos típica es la de un bebé de 2 a 8 semanas de edad que recibe lactancia materna exclusiva, o lactancia materna más fórmula, está en muy buen estado general y de un momento a otro hace deposiciones con sangre, sin que necesariamente las deposiciones sean más líquidas o más frecuentes. Generalmente no hay fiebre ni otros síntomas asociados excepto, algunas veces, llanto inconsolable o dolor al defecar. El hallazgo de sangre en las deposiciones obviamente alarma a la mamá y consulta inmediatamente…quiere saber qué está pasando y qué debe hacer. Continue reading “(13-77) Sangre en las deposiciones en un bebe pequeño – qué hacer y qué no hacer”
La situación más o menos típica es la de un bebé de 2 a 8 semanas de edad que recibe lactancia materna exclusiva, o lactancia materna más fórmula, está en muy buen estado general y de un momento a otro hace deposiciones con sangre, sin que necesariamente las deposiciones sean más líquidas o más frecuentes. Generalmente no hay fiebre ni otros síntomas asociados excepto, algunas veces, llanto inconsolable o dolor al defecar. El hallazgo de sangre en las deposiciones obviamente alarma a la mamá y consulta inmediatamente…quiere saber qué está pasando y qué debe hacer. Continue reading “(13-77) Sangre en las deposiciones en un bebe pequeño – qué hacer y qué no hacer”
(12-56) Gatifloxacina versus ciprofloxacina para shigelosis
El estudio. En un ensayo clínico de etiqueta abierta cuyo propósito fue evaluar la eficacia clínica y bacteriológica de gatifloxacina (una fluorquinolona de cuarta generación) en comparación con ciprofloxacina para tratar shigelosis en niños , Vinh H et al (ref) asignaron aleatoriamente 500 niños con disentería de dos hospitales del sur de Vietnam, una región con alta prevalencia de resistencia de Shigella a ácido nalidíxico, para recibir por vía oral gatifloxacina (10 mg/kg/día, una vez al día por 3 días, grupo GATI) o ciprofloxacina (30 mg/kg/día, dividido en 2 dosis por día por 3 días, grupo CIPRO). Para comparar los tratamientos, los investigadores eligieron como indicador principal de resultado la proporción de fracaso terapéutico en cada grupo; el indicador secundario elegido fue el tiempo hasta el cese de síntomas individuales.
Los métodos. Los participantes fueron niños de hasta 15 años de edad con historia de diarrea con moco o sangre de no más de 72 horas de duración; fueron excluidos aquellos con algún signo de infección severa (shock, ictericia, sangrado gastrointestinal), historia de haber recibido algún antimicrobiano por este episodio de diarrea, historia de hipersensibilidad a alguna de las drogas de estudio o presencia de trofozoitos de Entamoeba histolytica en las heces. Se hizo cultivo de heces al momento del enrolamiento en el estudio, los niños fueron tratados con el medicamento respectivo antes de conocerse el resultado del cultivo y continuaron en el ensayo aún si este cultivo fue negativo para Shigella o positivo para alguna otra bacteria enteropatógena. Todos los niños fueron tratados intrahospitalariamente y salieron de alta sólo cuando desaparecieron todos los síntomas. Se anotó diariamente las características de cada deposición así como la temperatura corporal y otros signos clínicos de cada niño hasta el alta. Después del alta los pacientes fueron invitados a regresar para una nueva evaluación a los 7 días. Se definió como fracaso terapéutico la persistencia de fiebre o cualquier otro signo de la enfermedad después de 120 horas desde iniciado el tratamiento. Para evaluar la eficacia microbiológica, se tomó un nuevo cultivo de heces a los 7 días después del alta y se definió como fracaso microbiológico la persistencia de cultivo positivo al enteropatógeno originalmente hallado.
La muestra. De 500 pacientes enrolados originalmente, 494 recibieron al menos una dosis del medicamento en estudio (249 gatifloxacina y 245 ciprofloxacina) y sus datos fueron usados en el análisis de intención-de-tratamiento (ITT). El cultivo de heces inicial dio positivo a Shigella en 61 (24.5%) pacientes del grupo GATI y 46 (18.8%) del grupo CIPRO. Veinticinco pacientes (10.0%) en el grupo GATI y 15 (6.1%) en el grupo CIPRO tuvieron cultivo positivo a Salmonella. Los demás pacientes (163 [65.5%] en el grupo GATI y 182 [74.3%] en el grupo CIPRO) tuvieron cultivo negativo. De los aislamientos de Shigella, 72 (67.3%) fueron S. sonnei, 33 (30.8%) S. flexneri y 2 (1.9%) S. boydii. Setenta y dos (67.3%) de todos los aislamientos de Shigella fueron resistentes a ácido nalidíxico (MIC ≥ 16 µg/ml). La edad promedio de los pacientes participantes fue de 19 meses, 58.9% fueron de sexo masculino, el tiempo promedio de enfermedad antes de entrar al estudio fue de 24 horas, 87.4% tenían fiebre (> 37.8°C) al momento del ingreso, 42.5% tenían historia de diarrea con sangre y los demás, historia de diarrea con moco sin sangre. No hubo diferencias entre los grupos en cuanto a las características clínicas iniciales. De los pacientes positivos a Shigella, sólo 46 en el grupo GATI y 35 en el grupo CIPRO retornaron a su cita de seguimiento, 7 días después del alta del hospital.
Los resultados. De todos los pacientes ITT, 57 (11.5%) hicieron fracaso terapéutico (30 en el grupo GATI y 27 en el grupo CIPRO, p = 0.72). El patrón clínico de fracaso en la mayoría fue persistencia de la diarrea. Hubo 9 pacientes con fracaso bacteriológico en el grupo CIPRO y 6 en el grupo GATI. No hubo diferencias entre los grupos en el tiempo hasta la resolución de los síntomas individuales. En el análisis por-protocolo (pacientes con cultivo positivo a Shigella), el riesgo de fracaso terapéutico fue similar en ambos grupos (6.6% en el grupo GATI y 10.9% en el grupo CIPRO, p = 0.49), independientemente de si la cepa fue o no resistente a ácido nalidíxico; tampoco hubo diferencia en el tiempo hasta la resolución de los síntomas individuales. En los pacientes con cultivo positivo a Salmonella el fracaso terapéutico fue más alto que en los pacientes con Shigella pero sin diferencia entre los grupos (52.0% en el grupo GATI y 60.0% en el grupo CIPRO, p = 0.62). En los pacientes con cultivo negativo el fracaso terapéutico fue de 8.0% en el grupo GATI y 6.0% en el grupo CIPRO (p = 0.48).
En conclusión. Los datos de este estudio demuestran que a pesar de un alto porcentaje de resistencia a ácido nalidíxico, ciprofloxacina sigue siendo una terapia efectiva para la disentería causada por Shigella. Este estudio demuestra también que gatifloxacina es tan efectiva como ciprofloxacina para el tratamiento de esta enfermedad, incluyendo la disentería con cultivo negativo. En este estudio se muestra que ambos productos actúan pobremente cuando la disentería es causada por Salmonella. Una nota de cautela debe tomarse en cuenta en la generalización de los hallazgos de este estudio con relación a shigelosis ya que el serogrupo predominante en este estudio fue S. sonnei, que se sabe es menos virulento que S. flexneri (ref).
- Se ha documentado recientemente que está ocurriendo, al menos en Asia, un dramático giro en la epidemiología de la shigelosis, en dos aspectos: 1) ha desaparecido S. dysenteriae (el serogrupo más virulento) y S. sonnei, que antes se encontraba casi exclusivamente en los países industrializados, está sustituyendo a S. flexneri, hasta hace poco el serogrupo más común en los países en desarrollo (ref) y 2) está cambiando el patrón de susceptibilidad de Shigella a los antibióticos con un elevado porcentaje de resistencia a ácido nalidíxico (ref) y una rápida emergencia de cepas resistentes a cefalosporinas de tercera generación (ref). Interesantemente, la resistencia a ácido nalidíxico generalmente correlaciona con disminución de la susceptibilidad in vitro a ciprofloxacina y otras fluoroquinolonas de primera generación (ref), que estaría mediado por mutaciones de resistencia comunes a varios antimicrobianos (ref). Los resultados del estudio que comentamos indica que tal correlación no pareciera ocurrir in vivo.
- Gatifloxacina es una fluoroquinolona de cuarta generación con actividad contra Gram positivos y Gram negativos con un espectro de acción más amplio que las fluoroquinolonas anteriores (ref). Como otras quinolonas, gatifloxacina penetra activamente en el citoplasma de las células fagocíticas y tiene por tanto actividad bactericida contra bacterias intracelulares como Shigella (ref). Gatifloxacina se absorbe bien en el tracto gastrointestinal con una biodisponibilidad de 100% por lo que se puede pasar a un paciente de terapia intravenosa a oral sin necesidad de ajustar la dosis; tiene un tiempo de vida media en plasma prolongado por lo que se puede administrar en una dosis al día (ref). Gatifloxacina está aprobado en los Estados Unidos para el tratamiento de neumonía adquirida en la comunidad, exacerbaciones agudas de bronquitis crónica, sinusitis aguda, infección urinaria complicada o no complicada, pielonefritis, gonorrea e infecciones no complicadas de la piel y faneras (ref). Varios ensayos clínicos han mostrado que gatifloxacina es muy efectiva en el tratamiento de fiebre tifoidea comparado con cefixima (ref), azitromicina (ref) o cloranfenicol (ref).
- Gatifloxacina es un medicamento con buen perfil de seguridad y tolerancia; los eventos adversos más frecuentemente reportados en adultos son náusea (8%), diarrea (4%), cefalea (4%) y mareos (3%) (ref). Se ha reportado un estado de disglicemia (híper o hipoglicemia) asociado al uso de gatifloxacina; aunque el riesgo de disglicemia parece bajo, algunos recomiendan monitorear la glucosa sanguínea durante el tratamiento (ref). Gatifloxacina parece un medicamento seguro para niños; en un estudio de 867 niños con otitis media recurrente u otitis media aguda que no responde a medicación de primera línea y que fueron subsecuentemente tratados con gatifloxacina, ninguno desarrolló artropatía (ref).
(12-52) Cuán buenas en calidad o útiles en aplicabilidad son las guías de manejo de la gastroenteritis aguda en niños?
J van den Berg y MY Berger del Department of General Practice, Erasmus Medical Center, Erasmus University Rotterdam, the Netherlands, decidieron hacer una revisión de las guías de manejo de gastroenteritis aguda (AGE) en niños, con el fin de identificar las razones de la baja influencia de estas guías en la práctica real de los médicos de los países industrializados (ref). Su hipótesis fue que estas guías podrían adolecer de inconsistencia en las recomendaciones, recomendaciones sin suficientes evidencias o inaplicabilidad de las recomendaciones en términos prácticos.
Los autores ubicaron y revisaron las guías desarrolladas y publicadas por organizaciones médicas profesionales que estuvieran disponibles en algún sitio web; adicionalmente hicieron una búsqueda bibliográfica sistemática y obtuvieron y revisaron los artículos que contenían guías, consensos o protocolos de manejo. Consideraron válidos para este análisis las guías, consensos y protocolos que fueron elaborados expresamente para el manejo de la gastroenteritis en niños y producidos por una organización profesional que representa oficialmente a usuarios como pediatras, gastroenterólogos o médicos generales. Se excluyeron las que se basaron exclusivamente en opiniones o que fueron diseñados para países en desarrollo o para niños con con-morbilidades severas. Los autores seleccionaron y analizaron ocho guías que reunieron estos criterios (2 de USA: Cincinnati Children’s Hospital Medical Center y CDC; 2 de UK: ARM y NICE; 1 de Canadá: Canadian Pediatric Society; 1 de Holanda: NHG; 1 de Europa: ESPGHAN/ESPID; 1 mundial: WGO). Estas guías fueron publicadas entre el 2001 (ARM) y el 2009 (NICE).
La calidad de cada guía se evaluó con la herramienta AGREE (Appraisal of Guidelines for Research and Evaluation) (ref), que incluye 23 ítems agrupados en seis categorías (1/ alcance y finalidad, 2/ participación de las partes interesadas, 3/ rigurosidad del desarrollo, 4/ claridad y presentación, 5/ aplicabilidad y 6/ independencia editorial) y un ítem de evaluación global que juzga si la guía tiene o no méritos para recomendar su uso en la práctica clínica. Se definió como recomendación consistente si más del 50% de las guías revisadas daban la misma recomendación sobre un determinado tema. Las recomendaciones se consideraron aplicables o generalizables a la práctica clínica cotidiana si la evidencia que sustenta la recomendación fue obtenida de estudios con pacientes ambulatorios en centros de atención primaria o si participó al menos un médico general (general practitioner) en los casos en que la recomendación fue por consenso.
En la evaluación de calidad destacan las guías NICE y ESPGHAN/ESPID aunque en aplicabilidad, la guía NICE obtuvo un puntaje de 88.9% y la guía ESPGHAN/ESPID sólo 11.1%. Las guías con el más bajo puntaje en calidad fueron CDC, Canadian Pediatric Society y WGO.
El número de recomendaciones para diagnóstico y tratamiento es muy variable de guía a guía. La guía ESPGHAN/ESPID es la que hace más recomendaciones (n=74) pero sólo 47 (63.5%) son basadas en evidencias. La guía NICE hace 35 recomendaciones, de las cuales 21 (60%) son basadas en evidencias. La guía del CDC hace 35 recomendaciones pero sólo 40% son basadas en evidencias. La guía WGO no dice cuál fue la fuente de evidencia de sus recomendaciones.
En relación a los signos o síntomas para catalogar el grado de deshidratación la revisión encuentra que 1) el signo de pliegue es el único que aparece en todas las guías, 2) hay una enorme inconsistencia entre las guías sobre cuál signo indica qué grado de deshidratación y 3) ninguno de los signos ha sido estudiado en el contexto de atención primaria.
Todas las guías excepto una (Cincinnati Children’s Hospital Medical Center) recomiendan el uso de una solución de rehidratación oral (SRO) de baja osmolaridad para tratar o prevenir la deshidratación. Esta recomendación está basada en evidencias de muy buena calidad. Las recomendaciones sobre la cantidad de SRO a administrar, sin embargo, son inconsistentes. Todas las guías recomiendan que 1) la lactancia materna no deba interrumpirse durante la rehidratación y el resto del tratamiento, 2) que un alimento apropiado para la edad deba administrarse inmediatamente después de completar la rehidratación (4-6 horas) y 3) que es innecesario diluir la fórmula o utilizar una fórmula libre de lactosa.
Seis guías recomiendan 1) no usar bebidas con alto contenido de carbohidratos, 2) no usar antieméticos y 3) que los antidiarreicos no son de beneficio o no deben usarse. Las recomendaciones sobre el uso de probióticos son inconsistentes.
Cuatro guías recomiendan cuándo un paciente debe ser visto por un médico, según los siguientes factores de riesgo: corta edad, diarrea de gasto alto, deshidratación severa, vómito persistente, diarrea con sangre o asociada a fiebre alta, diarrea persistente o pre-existencia de alguna enfermedad de fondo relevante. Seis guías recomiendan solicitar un cultivo de heces cuando la diarrea es con sangre. Tres guías indican que los vómitos no son una contraindicación para la hidratación oral.
Los autores concluyen que el alto porcentaje que todavía subsiste de recomendaciones no basadas en evidencias y la inconsistencia de las guías entre sí son el factor principal de la poca adherencia a las recomendaciones en la práctica diaria. Para remediar esta situación sugieren que se hagan más estudios en al menos los siguientes temas: 1) determinar el valor de los signos clínicos de deshidratación para definir el grado de deshidratación de un niño que se atiende en un servicio de atención primaria; 2) establecer la cantidad optima de SRO que debe administrarse para cada grado de deshidratación; 3) determinar qué consideraciones llevan al médico a prescribir medicamentos a niños con gastroenteritis aguda y definir si estas consideraciones son o no validas. Finalmente, los autores también abogan por que se adopte un sistema uniforme de graduación, como el sistema GRADE (ref), para referirse a la robustez de una recomendación contenida en una guía.
- La rehidratación oral (TRO) es una terapéutica que se usa realmente muy poco (ref), pese a que su eficacia y aplicabilidad está basada en una montaña de evidencias. Este fiasco con la TRO es un buen ejemplo de cómo muchos médicos prefieren basar sus decisiones en su formación inicial o su experiencia con pacientes individuales que en las evidencias. El mero hecho de haber leído o estar familiarizado con recomendaciones formuladas por instituciones académicas a través de guías de manejo clínico, no garantiza que los médicos las apliquen en su práctica diaria. En un estudio en USA, tres cuartos de los médicos que fueron encuestados y que decían conocer de cerca las recomendaciones de la American Academy of Pediatrics acerca del uso de TRO, seguían usando exclusivamente rehidratación intravenosa en niños con deshidratación moderada (ref). En otro estudio, un número importante de médicos de emergencias pediátricas, a quienes se les mostró los datos que refutaban el argumento que TRO tomaba más tiempo del personal de salud y que dijeron entonces que usarían TRO para deshidratación leve o moderada, en realidad continuaron usando rehidratación intravenosa; esto fue especialmente más prevalente en médicos que se habían graduado en la escuela de medicina más tempranamente (ref). Es claro que hay otras barreras no explícitas que deben ser exploradas para incrementar la práctica de la medicina basada en evidencias.
- El camino para pasar de la medicina basada en la experiencia a la medicina basada en la evidencia es largo y difícil. La medicina basada en evidencias es “el proceso de convertir un problema clínico en preguntas y de allí, sistemáticamente, revisar, evaluar y utilizar los hallazgos de investigaciones clínicas contemporáneas como la base para tomar decisiones clínicas y proporcionar la atención más óptima posible al paciente.” (ref) Este proceso demanda del médico tiempo y capacitación para evaluar críticamente la extensa literatura médica y una actitud diferente para aplicar lo que otros aconsejan.
- El desarrollo y difusión de guías de manejo es un esfuerzo de una institución para entregarle al médico un conjunto de recomendaciones basada en evidencias que usualmente es elaborado por un equipo calificado de expertos en el tema. Los autores del artículo que comentamos aquí nos hacen ver que aún estas guías adolecen de precisión y consistencia cuando se usan herramientas como AGREE y GRADE para evaluar su contenido. Es notable que en una patología tan prevalente como la gastroenteritis aguda en niños sólo cuatro de las ocho guías actualmente disponibles pueden pasar aceptablemente un escrutinio riguroso de calidad y consistencia. La aplicabilidad seguirá siendo un problema porque tiene que ver con consideraciones más prosaicas como saber cuál es la verdadera motivación que puede llevar a un médico a mudarse de la medicina autoritaria a la medicina científica.
(12-51) Helicobacter pylori protege contra Shigella y otras infecciones intestinales
Cohen D et al del Department of Epidemiology and Preventive Medicine, School of Public Health, Sackler Faculty of Medicine, Tel Aviv University, Israel, diseñaron un estudio caso-control con el propósito de averiguar si la infección por Helicobacter pylori confería algún tipo de protección contra infecciones intestinales (ref). El estudio se hizo con soldados israelíes conscriptos, varones, de 18 a 21 años de edad, seleccionando como casos (n = 177) a aquellos que consultaron por diarrea en los servicios médicos de su unidad y que proporcionaron una muestra de heces para cultivo. Los casos fueron positivos para Shigella sonnei (n = 66), Escherichia coli enterotoxigénica (ETEC) (n = 31) o negativos para patógenos bacterianos (n = 80, diarrea de etiología desconocida). Los controles (n = 418) fueron seleccionados entre soldados de la misma unidad sin enfermedad diarreica en el mismo periodo. Se analizó la presencia de anticuerpos tipo IgG contra H. pylori y anticuerpos tipo IgG e IgA contra el lipopolisacárido de S. sonnei en una muestra de suero pre-existente que había sido obtenida al comenzar su servicio militar en todos los soldados participantes. La proporción de sujetos con evidencia serológica de infección por H. pylori fue significativamente más alta en los controles (56.0%) que en los que tenían infección intestinal de etiología desconocida (36.3%) (OR ajustado, 0.43; 95% CI: 0.24-0.77; P = 0.005) y en los que tenían infección por S. sonnei (36.3%), aún ajustando a variables socio-demográficas y pre-existencia de anticuerpos tipo IgA (OR ajustado, 0.37; 95% CI: 0.14-0.95; P = 0.03) o IgG (OR ajustado, 0.38; 95% CI: 0.14-0.99; P = 0.04) contra S. sonnei. La asociación entre infección por H. pylori y diarrea por ETEC fue similar y en la misma dirección aunque no estadísticamente significativa. Los autores concluyen que estos hallazgos sugieren que el H. pylori tiene un rol activo de protección contra shigellosis y quizás también contra otras enfermedades diarreicas, mas allá de la protección adquirida en forma natural de infecciones previas con patógenos entéricos.
- Observaciones clínicas (ref) y estudios experimentales en humanos (ref) y animales de laboratorio (ref) indican que los enteropatógenos no sobreviven en un medio acido y por tanto el ácido gástrico puede ser una barrera de protección contra las infecciones intestinales. Un extenso meta-análisis publicado muy recientemente demuestra que la hipoclorhidria generada por el uso de inhibidores de bomba de protones favorece la colonización bacteriana e incrementa la susceptibilidad a infecciones intestinales (ref).
- Se ha señalado que la infección aguda por H. pylori causa hipoclorhidria que empieza dos semanas después de la infección y que puede durar hasta cuatro meses (ref). En teoría, los pacientes infectados con H. pylori pueden entonces ser más susceptibles a adquirir infecciones intestinales al menos durante este periodo de hipoclorhidria. Estudios epidemiológicos muestran aparentemente esta posible asociación (ref) (ref) (ref).
- El estudio de Cohen D et al (ref), que comentamos aquí, y algunos otros más publicados previamente (ref) (ref), muestran al contrario que la infección por H. pylori confiere una protección contra las infecciones intestinales. Estos hallazgos contradictorios se podrían explicar de la siguiente manera: 1) Durante el curso de una infección crónica por H. pylori se induce una respuesta inflamatoria local y sistémica persistente que mantienen en actividad la respuesta inmune (ref), lo que podría conferir una protección inespecífica contra los enteropatógenos; 2) En la infección crónica con H. pylori y gastritis predominantemente antral hay mas bien un estado de hiperclorhidria que potencia la barrera acida gástrica contra los enteropatógenos (ref); 3) H. pylori induce el incremento de secreción de anticuerpos IgA que tienen un rol fundamental en impedir la colonización de la mucosa intestinal por patógenos intestinales (ref); 4) Las cepas CagA de H. pylori inducen la síntesis de péptidos específicos que incrementan la resistencia contra patógenos entéricos (ref). Las evidencias parecen más fuertes para apoyar la hipótesis del rol protector que tendría H. pylori para prevenir las infecciones intestinales.
- En la última década se está describiendo una tendencia a la disminución de la incidencia de infección por H. pylori en los países en desarrollo (ref) (ref). Si esta tendencia es real, se puede predecir que paralelamente podrían aumentar las infecciones intestinales.
(11-40) Una evaluación hecha de manera sistemática puede identificar por lo menos un resultado anormal que podría ser la causa del dolor en la mayoría de niños con dolor abdominal recurrente
Investigadores de tres centros médicos no académicos de Holanda evaluaron de manera consecutiva 220 niños de 4 a 16 años de edad con dolor abdominal recurrente (RAP) que fueron referidos por sus médicos primarios para indagar la causa del dolor. Los pacientes fueron evaluados sistemáticamente siguiendo en todos ellos un protocolo que incluía una historia clínica estándar para caracterizar el dolor y los síntomas concomitantes, examen físico y una serie de exámenes auxiliares. Los exámenes incluyeron hemograma completo, velocidad de sedimentación, perfil renal y hepático, amilasa, calcio, fósforo, albúmina, IgE total, RAST con un panel de 6 alérgenos alimentarios, IgA total, anticuerpos de enfermedad celiaca, examen completo de orina, cultivo de orina, serología para Helicobacter, serología para Yersinia (inmunoblot), cultivo de heces, examen parasitológico de heces (incluyendo tinción de Kinyoun), antígeno fecal de Giardia por ELISA, antígeno fecal de Helicobacter por ELISA, prueba de hidrógeno en aliento con lactosa y fructosa, ecografía abdominal y radiografía simple de abdomen. Otros exámenes como endoscopía, serie de esófago-estómago-duodeno con contraste y pHmetría esofágica de 24 horas se hicieron sólo en casos seleccionados, si se consideraba necesario. El promedio de edad de inicio del dolor fue 6 años y el promedio de tiempo de enfermedad con RAP fue 2.6 años (20% de los niños tenían dolor por al menos 5 años). Dos de cada tres (66%) de los pacientes tenían dolor 4 a 7 días a la semana, 54% habían sido despertados por el dolor en la noche al menos una vez y 15% habían perdido al menos un día de clases en la escuela a la semana. En poco menos de la mitad (46%) de los pacientes el dolor disminuía después de la defecación. Todos los niños tenían un peso y talla normales para la edad. En 11% había distensión abdominal, en 57% el abdomen estaba lleno o se palpaba el colon y en 26% el recto estaba ocupado al tacto rectal. Los exámenes dieron algún resultado positivo que podría ser la causa del dolor en 88% de los pacientes. Se encontró protozoarios, principalmente Dientamoeba fragilis, en 33%, Yersinia enterocolitica en 12% e infección por H. pylori en 11%. La radiografía simple de abdomen mostró signos de constipación en 36%. Los autores concluyen que un enfoque sistemático como el que utilizaron con estos pacientes permite identificar al menos un resultado anormal que podría ser la causa orgánica del dolor abdominal recurrente en un alto porcentaje de pacientes que debería tomarse en cuenta antes de etiquetarlos como portadores de dolor abdominal funcional según los criterios de Roma. (ref)
(11-19) Métodos inmunoenzimáticos y moleculares son más sensibles que cultivo para detección de Campylobacter en muestras fecales
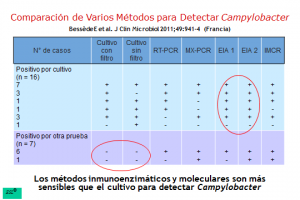 Investigadores del Centre National de Référence des Campylobacters et Helicobacters de Francia analizaron 242 muestras fecales para comparar la capacidad de detectar Campylobacter por métodos inmunoenzimáticos y moleculares en comparación con el cultivo. Las muestras provenían de pacientes sintomáticos de cualquier edad hospitalizados por menos de 48 horas y se cultivaron en microaerobiosis a 37°C tanto directamente en un medio selectivo con suplemento antibiótico como en un medio sin antibiótico con filtro Millipore. Las colonias sospechosas fueron confirmadas como Campylobacter en base a su motilidad, morfología con Gram y actividad de oxidasa. Al mismo tiempo, todas las muestras fueron examinadas mediante un método molecular extrayendo y analizando el DNA genómico con dos sistemas de PCR (in-house RT-PCR y Seeplex Diarrhea ACE Detection). Para el método inmunoenzimático se usaron dos en formato ELISA (Premier Campy y RidaScreen Campylobacter) y uno en formato de inmunocromatografía (InmunoCard Stat!Campy). De las 242 muestras examinadas, 23 (9.5%) fueron positivas para Campylobacter por alguno de los tres métodos. El cultivo detectó sólo 16 (69.6%) de las 23 muestras positivas. De las siete muestras negativas en cultivo, seis fueron positivas por todos los métodos moleculares e inmunoenzimáticos. La muestra restante fue detectada únicamente por PCR Seeplex Diarrhea ACE Detection y por Premier Campy y InmunoCard Stat!Campy. Los autores resaltan la falta de sensibilidad del cultivo y consideran que ELISA es actualmente el método más preciso para detectar Campylobacter en muestras fecales. (ref) (link)
Investigadores del Centre National de Référence des Campylobacters et Helicobacters de Francia analizaron 242 muestras fecales para comparar la capacidad de detectar Campylobacter por métodos inmunoenzimáticos y moleculares en comparación con el cultivo. Las muestras provenían de pacientes sintomáticos de cualquier edad hospitalizados por menos de 48 horas y se cultivaron en microaerobiosis a 37°C tanto directamente en un medio selectivo con suplemento antibiótico como en un medio sin antibiótico con filtro Millipore. Las colonias sospechosas fueron confirmadas como Campylobacter en base a su motilidad, morfología con Gram y actividad de oxidasa. Al mismo tiempo, todas las muestras fueron examinadas mediante un método molecular extrayendo y analizando el DNA genómico con dos sistemas de PCR (in-house RT-PCR y Seeplex Diarrhea ACE Detection). Para el método inmunoenzimático se usaron dos en formato ELISA (Premier Campy y RidaScreen Campylobacter) y uno en formato de inmunocromatografía (InmunoCard Stat!Campy). De las 242 muestras examinadas, 23 (9.5%) fueron positivas para Campylobacter por alguno de los tres métodos. El cultivo detectó sólo 16 (69.6%) de las 23 muestras positivas. De las siete muestras negativas en cultivo, seis fueron positivas por todos los métodos moleculares e inmunoenzimáticos. La muestra restante fue detectada únicamente por PCR Seeplex Diarrhea ACE Detection y por Premier Campy y InmunoCard Stat!Campy. Los autores resaltan la falta de sensibilidad del cultivo y consideran que ELISA es actualmente el método más preciso para detectar Campylobacter en muestras fecales. (ref) (link)
