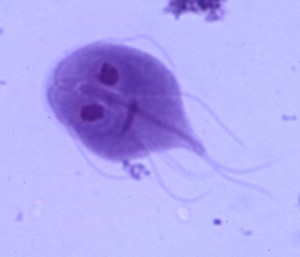
Una persona, niño o adulto, con diarrea y vómitos por norovirus puede excretar en las heces partículas del virus en cantidades considerables por varias semanas después que los síntomas se resolvieron. Este periodo de excreción asintomática del norovirus puede durar dos a tres semanas, pudiendo ser aún más prolongado si el paciente está inmunosuprimido, tiene cáncer o alguna otra forma de debilitamiento general. Por otro lado, en las infecciones gastrointestinales, no sólo las causadas por norovirus, una persona sana, con su sistema inmune intacto, puede adquirir la infección, no hacer síntomas y sin embargo excretar el microorganismo en las heces.
La excreción fecal asintomática de un agente infeccioso del aparato gastrointestinal no es exclusivo del norovirus. Otros enteropatógenos (virus, bacterias o parásitos) hacen lo mismo. A qué se debe esto? Bueno, algunas veces depende de factores del huésped (la persona con la infección) y otras a las características del microbio. En realidad, el que una persona haga o no síntomas de una infección que ha adquirido depende de: 1) La fortaleza de su sistema inmune, 2) La memoria de su sistema inmune, resultante de contactos anteriores con el mismo patógeno, 3) La cantidad de microorganismo ingerido al momento de adquirir la infección (la cantidad ingerida puede ser suficiente para causar excreción pero no síntomas) y 4) de variantes genéticas del microorganismo que da origen a cepas con mayor o menor virulencia. En cuanto a porqué continúa la excreción del agente infeccioso mucho tiempo después que los síntomas de la enfermedad se han resuelto, no hay una explicación clara pero ilustra la noción que en las infecciones en general, el periodo de manifestación de síntomas es sólo una parte de todo el proceso infeccioso que comprende además la fase pre-sintomática (incubación) y la post-sintomática (convalecencia).
Cuáles son las implicaciones de la excreción asintomática de un microrganismo infeccioso gastrointestinal transmisible? Primero, se favorece la diseminación de la infección a huéspedes nuevos sin advertencia alguna. La transmisión es por contaminación fecal-oral, que no es otra cosa que el traslado del microorganismo de la materia fecal a la boca, sea directamente o por medio de agua o alimentos. Segundo, se hace más difícil el control de la transmisión en situaciones de brote epidémico que pueden ocurrir en cruceros, establecimientos educativos, centros recreacionales o restaurantes. En la infección con síntomas uno tiende a adoptar por lo menos algunas medidas, como lavarse las manos, a fin de evitar el contagio. Si no hay síntomas, sencillamente no hay aviso.
Otra implicación tiene que ver con los exámenes que se hacen para el diagnóstico etiológico de la enfermedad diarreica. Ahora que se utilizan con mayor frecuencia los métodos moleculares para detectar enteropatógenos, especialmente en plataformas de detección múltiple como el sistema FilmArray®, no es infrecuente ver infecciones mixtas con 2 o más patógenos detectados. Por un lado, estos sistemas son notoriamente más sensibles que los basados en detección de antígenos, simplemente porque el límite de detección (el nivel mínimo de partículas presentes en la muestra por debajo del cual la prueba no las detecta) es mayor para antígenos que para secuencias genéticas. Por ejemplo, la sensibilidad de la detección de norovirus en muestras fecales con ELISA (que detecta un antígeno específico del virus) es de 78.6%, mientras que con PCR (que detecta una secuencia específica del RNA del virus) la sensibilidad se eleva a 94.5%. Si el reporte de resultados de una PCR múltiple como el Panel Gastrointestinal de FilmArray® indica que se han detectado dos o más enteropatógenos queda en manos del médico interpretar el significado clínico de este resultado. Puede ser real que haya una infección mixta, por más de un enteropatógeno. No hay una razón válida para negar esta posibilidad a priori. Pero, si el cuadro clínico no concuerda con el hallazgo de alguno de los patógenos identificados por el panel, habrá que considerar que ese patógeno podría ser el rezago de una infección anterior que ocurrió semanas atrás. Como siempre, un examen de laboratorio, por más bueno que sea, no exime al médico de la necesidad de hacer un buen diagnóstico clínico.
Referencias
Marques Mendanha de Oliveira D et al. Monitoring of Calicivirus among day-care children: evidence of asymptomatic viral excretion and first report of GI.7 Norovirus and GI.3 Sapovirus in Brazil. J Med Virol 2014; 86:1569-75. PubMed 24123103
O’Ryan ML et al. Symptomatic and asymptomatic rotavirus and norovirus infections during infancy in a Chilean birth cohort. Pediatr Infect Dis J 2009; 28:879-84. PubMed 19672213
Aoki Y et al. Duration of norovirus excretion and the longitudinal course of viral load in norovirus-infected elderly patients. J Hosp Infect 2010; 75:42-6. PubMed 20304524
Frange P et al. Prevalence and clinical impact of norovirus fecal shedding in children with inherited immune deficiencies. J Infect Dis 2012; 206:1269-74. PubMed 22872736
Ludwig A et al. Quantitative detection of norovirus excretion in pediatric patients with cancer and prolonged gastroenteritis and shedding of norovirus. J Med Virol 2008; 80:1461-7. PubMed 18551595 .
Levine MM et al. Factors that explain excretion of enteric pathogens by persons without diarrhea. Clin Infect Dis 2012; 55 Suppl 4:S303-11. PubMed 23169942
Castriciano S et al. Comparison of the RIDASCREEN norovirus enzyme immunoassay to IDEIA NLV GI/GII by testing stools also assayed by RT-PCR and electron microscopy. J Virol Methods 2007; 141:216-9. PubMed 17208311
H Henke-Gendo C et al. New real-time PCR detects prolonged norovirus excretion in highly immunosuppressed patients and children. J Clin Microbiol 2009; 47:2855-62. PubMed 19625473

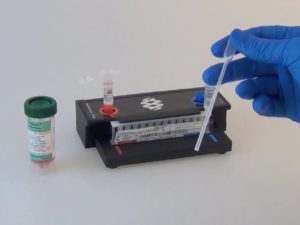
 Es una maravilla. GastroLab lo tiene. Es simplemente genial. Tecnología de punta ingeniosamente simplificada para hacer el diagnóstico etiológico, rápido e integral, de infecciones del sistema nervioso central, gastrointestinales, respiratorias y de la sangre. Obtienes la muestra, sacas la bolsa FilmArray® de su envase sellado al vacío. Colocas la bolsa en la estación de carga de bolsas. En el extremo azul de la bolsa cargas la solución hidratante para rehidratar los reactivos liofilizados que están en el accesorio de la bolsa. Sacas el vial de inyección de muestra, le agregas una solución buffer y enseguida una pequeña alícuota de la muestra. Cargas la solución buffer con la muestra en el extremo rojo de la bolsa. Insertas la bolsa en una ranura del equipo que hace el PCR (reacción en cadena de la polimerasa). Escaneas el código de barras de la bolsa para cargar los datos del paciente. Le das START al equipo y voilà.
Es una maravilla. GastroLab lo tiene. Es simplemente genial. Tecnología de punta ingeniosamente simplificada para hacer el diagnóstico etiológico, rápido e integral, de infecciones del sistema nervioso central, gastrointestinales, respiratorias y de la sangre. Obtienes la muestra, sacas la bolsa FilmArray® de su envase sellado al vacío. Colocas la bolsa en la estación de carga de bolsas. En el extremo azul de la bolsa cargas la solución hidratante para rehidratar los reactivos liofilizados que están en el accesorio de la bolsa. Sacas el vial de inyección de muestra, le agregas una solución buffer y enseguida una pequeña alícuota de la muestra. Cargas la solución buffer con la muestra en el extremo rojo de la bolsa. Insertas la bolsa en una ranura del equipo que hace el PCR (reacción en cadena de la polimerasa). Escaneas el código de barras de la bolsa para cargar los datos del paciente. Le das START al equipo y voilà.